pHのはなし:pH測定方式
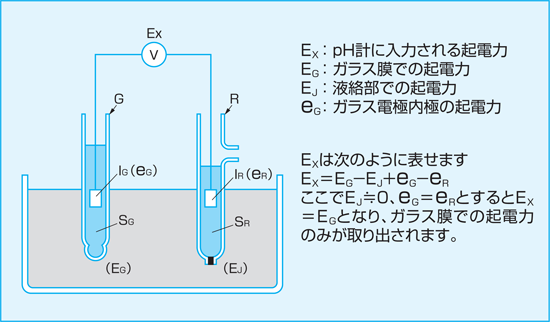
水素イオンに応答する特殊なガラス膜で作られた電極を被測定液に浸すと、ガラス膜の表面で水素イオン活量に対応した起電力を発生します。発生した起電力は、理論上単独では取り出せないので、基準となる電極との間に電圧計を接続し、基準の電極との電位差として電圧計(pH計)に表示されます。水素イオン活量を表す指標は「pH」といい、pHと水素イオン活量
〔H+〕はpH=−log〔H+〕の関係があります。
pHを測定するとき、あらかじめ、pH値が分かっているpH標準液でpH計を校正しておけば、pHに対応して発生した起電力から直接pH値を知ることができます。
ここでpHに応答する特殊なガラス膜を有する電極をガラス電極、基準の電極を比較電極といい、比較電極は内部に塩化カリウムの高濃度液、その先端に液絡部が備えられています。
液絡部は被測定液と接する部分で、一般には多孔性セラミックが用いられています。比較電極は、液絡部で被測定液と接しますが、常に一定起電力を発生し、この起電力を基準にガラス電極との電位差を求めていきます。
pH測定の理論式は、理論的には下記の式のように表せます。

ここで59.16(25℃)は理論的傾きといい、1pH変化したときの電位差ですが、この傾きは上記の式から分かるように温度の関数であるため温度変化により変化します。pH計では温度により変化した傾きを温度補償という方式で補正し、正しくpH測定ができるように工夫されています。

